2019年中药质量与安全风险防控论坛提出,要树立符合中药特点的检验和监管理念,构建全产业链生产技术规范和质量标准体系,实施全产业链质量提升行动——
严把中药质量安全风险防控关
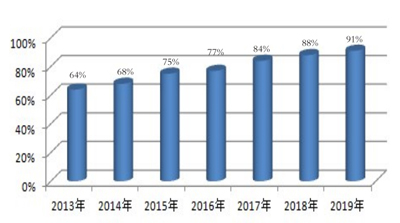
(中药材及饮片抽验合格率)
过去一年,中药质量总体向好,但存在的问题仍有待于探索解决,为中药产业高质量发展提供动力。
2019年12月28~30日在湖北武汉召开的2019年中药质量与安全风险防控论坛上,中国中药协会中药质量与安全专业委员会主任委员、中国食品药品检定研究院中药民族药检定所所长马双成表示,要树立符合中药特点的检验和监管理念,构建全产业链生产技术规范和质量标准体系,开展全产业链质量提升行动。
中药质量总体向好
马双成在作2019年中药质量报告中介绍,去年组织开展的全国中药材及饮片专项抽验结果显示,共抽验中药材及饮片54188批次,合格的有49188批次,合格率91%。而2019年之前六年的抽验合格率分别为64%、68%、75%、77%、84%、88%,合格率呈逐年上升势头。2019年进行的中成药评价性品种有37个,共4825个批次,按现行法定药品标准检验合格率为99.4%,总体质量良好。
但中药质量仍然存在诸多问题,安全风险不容忽视。马双成指出,中药材及饮片的问题主要表现在伪品、栽培变异以及品质方面。如中药材栽培,以秧播改变植物的传统生长方式,导致性状变异大,品质明显下降;种植加工不规范现象突出,如盲目引种或非道地产区种植、滥用农药和生长调节剂、生长年限不够等。还有以伪品冒充正品、不同药材品品种混用、非药用部位杂质过多、非法染色增重,炮制贮藏不当、硫黄熏蒸过度以及重金属农残问题。
中成药质量涉及原料、辅料、工艺、包装等方面,抽验不合格项目主要集中在含量测定和装量差异,其次为崩解时限。2019年开展的探索性研究还发现了额外添加淀粉粒制丸、动物药质量、部分无质控成分含量、企业间及企业批次间差异大等问题。
2019年的中成药评价性品种主要以胶囊剂为主,涉及片剂、丸剂、颗粒剂、糖浆剂、口服液、注射液、煎膏剂等多个传统剂型与新剂型,其中包括20个国家基本药物(2019版)目录品种。中国食品药品检定研究院戴忠研究员分析,影响中成药质量的问题,主要是中药材资源紧张导致有关品种质量下降,污染问题导致安全风险增加等。
南京中医药大学蔡宝昌教授认为中药饮片质量问题堪忧。近3年来,中药饮片质量不合格率占整个药品不合格的60%,近200家中药饮片企业被收回GMP证书。
近年来,中药安全性事件屡屡发生,而中药安全性标准数量少且分散不成体系。中国食品药品检定研究院中药民族药检定所金红宇研究员表示,总体而言,中药安全性保障能力不足,难以有效应对发展中的风险,亟待构建中药重金属、农药残留初步风险评估及药品标准体系。
切实防控质量风险
为保障中药质量安全,有效防范风险,应树立符合中药特点的检验和监管理念。
马双成认为,一是针对中药的属性多样、用途多样,检验和监管应有所区别;二是秉持传承和创新的态度,既追求一致性,也尊重差异性;三是寻找真正的质量标准,建立评价标准;四是构建全产业链生产技术规范和质量标准体系。他强调,要开展全产业链质量提升行动,注重源头治理,规范生产过程,完善追溯体系,开展质量评价,并通过发挥行业协会的作用,实现共建共治共享。
戴忠认为,采用评价抽验工作模式具有优越性,通过标准检验与探索性研究并行,集中检验、集中分析,研究质量差异、标准差异,可有效促进中成药质量提升。标准检验是检验部门根据国家药品标准对药品进行的全项目检验,是药品质量评价的基础,也是行政监管的法律依据。而探索性研究是检验部门以问题为导向对药品畸形的全方位质量评价研究,是药品质量评价的有力补充。
2019年开展的探索性研究发现,在中成药质量方面存在中药材原料质量、处方中药味多、辅料、包装及包装材料、处方与制法、生产工艺、掺伪掺假药材用于成方制剂生产、污染物质残留以及投料等问题。同时还针对中药材及饮片掺杂使假问题进行了相关补充检验方法研究,如探索构建中药胶类饮片及相关中成药掺牛皮、马皮、猪皮,半夏药材及饮片掺虎掌南星、三七粉掺三七茎叶粉、柴胡制剂掺伪等掺杂使假的补充检验方法。
中药安全性标准数量目前远远落后于食品、农产品。药典公示的标准是对中药材最基本的质量要求和安全保障。金红宇表示,药品质量是生产出来的,不是检测出来的,药品生产企业是质量责任主体。而药典标准将起到规范产业发展的引导作用,促进中药材种植与饮片加工行业向现代化、规模化、规范化发展。“检测仪器、设备固然重要,但规范化种植和技术人才的培养才是核心竞争力。建议相关部门改革监管机制,倡导基于风险的检测,有效降低企业成本。同时在污染物监测方面,仿效食品、农产品管理模式,建立国家监测评价体系,以风险管理为核心目标,以国家投入为现阶段主要手段”。
遵法依规高质量发展
新修订的《药品管理法》2019年12月1日施行,强化了药品研制阶段管理、上市后监管、药品的供应保障,确立了一系列制度包括药品上市许可持有人制度、药品全程追溯制度、药物警戒制度、附条件审批制度、优先审批制度,将有力推进药品监管现代化。
国家药监局药品注册司中药民族药处王海南介绍,药品上市许可持有人制度是基本制度和核心制度,是规定药品上市许可持有人对药品全生命周期承担相应责任的一种现代药品管理制度,贯穿于药品研制、生产、经营、使用全过程。有利于落实企业主体责任、强化全程管理,推动管理创新、实现管理升级。新增和修订的条款有,国家保护野生药材资源和中药品种,鼓励培育道地药材;建立和完善符合中药特点的技术评价体系,促进中药传承创新;中药饮片生产企业履行药品上市许可人的相关义务,保证中药饮片安全、有效、可追溯;用信息化的手段保障药品生产、经营、使用的质量安全。
王海南认为,针对中药安全性,应加强以临床为导向的安全性评价研究,加强外源性有害物质限量的制定。针对中药有效性,应加强以临床为导向的有效性评价研究,树立整体观——整体质控、标准汤剂,探索建立生物活性检测方法。
新版药典编制大纲要求建立和完善安全性检测方法,全面制定中药材和饮片中重金属及有害元素、农药残留的限量标准。国家药典委员会中药标准处石上梅介绍,根据大纲要求,在安全性控制方面开展了中药材和饮片中重金属及有害元素、农药残留限量标准的专项课题研究,包括重金属及有害元素限量标准研究,涉及160种药材与饮片,铅、镉、砷、汞、铜5种重金属元素;农药残留限量标准研究,涉及10种药食同源中药材及饮片,33种禁用农药品种。标准研究同时注重继承传统中医药文化,以中医临床为导向,以科学研究为基础,开展标准工作。
金红宇介绍,新版药典编制大纲提出既要有效控制外源性污染物对中药安全性造成的影响,全面制定中药材、饮片重金属及有害元素、农药残留的限量标准,全面制定易霉变中药材、饮片真菌毒素限量标准;还要有效控制内源性有毒成分对中药安全性产生的影响,重点解决符合中药特点的肝肾毒性预测及评价规范,制定中药安全用药检验标准及指导原则。同时还要求,强化中药标准的专属性和整体性,不断创新和完善中药分析检验方法;重点开展基于中医临床疗效的生物评价和测定方法,探索建立以化学标志物和生物标志物相融合的中药整体质量控制体系。
推进中药材和饮片生产方式转型升级,对中药质量风险防控和中药产业高质量发展具有极其重要的意义。蔡宝昌建议要坚持继承创新,培训专业技术人才;试点产地加工饮片生产一体化;推进联动线设备;推动工艺规范和标准化;推进追溯体系建设。特别是要大力创新生产和营销模式,引导饮片企业由原来的小而全,生产优势品种和特色品种,实现规范化、标准化、集约化、规模化生产,确保质量和效率。同时使传统营销模式变成互联网为主的线上线下联动、集中配送模式,形成中药材、饮片和中成药区块链,营造产品质量可靠、配送及时、服务到位、消费者满意的产业发展环境。
2019年中药质量与安全风险防控论坛由中国中药协会中药质量与安全专委会、中国中药协会中药数字化专委会主办,龟鹿药业、九信中药、东阿阿胶、神威药业承办。(任壮)
(M)